2010년05월09일 81번
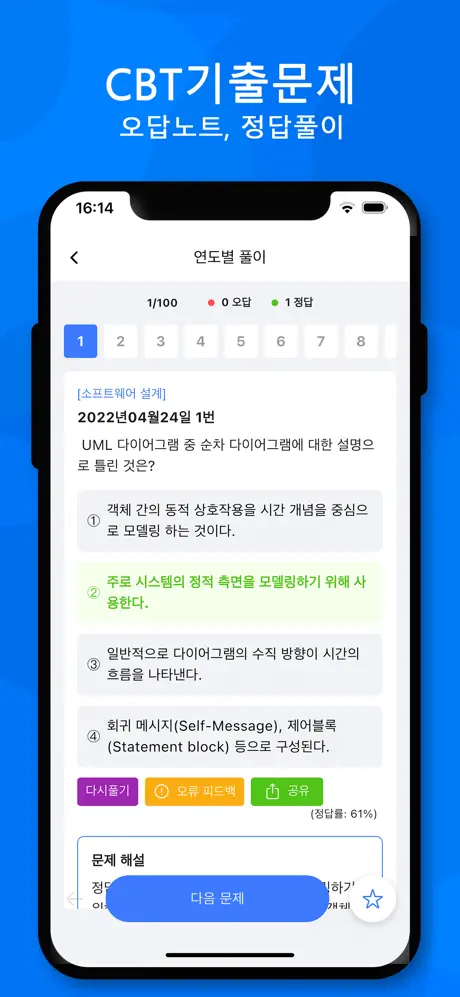
[생물공학개론] 알데하이드의 산화반응 ①과 ATP의 가수분해반응 ②의 free-energy change가 다음과 같은 때 ③반응의 free-energy change는 몇 kcal/mol인가?

- ① 0.3
- ② 14.3
- ③ -14.3
- ④ -0.3
(정답률: 43%)
문제 해설
알데하이드의 산화반응과 ATP의 가수분해반응은 모두 엔트로피를 증가시키는 반응이므로 ΔG 값이 음수이다. 따라서 두 반응의 ΔG 값을 더하면 ③반응의 ΔG 값을 구할 수 있다.
ΔG(①) = -14.3 kcal/mol
ΔG(②) = -7.3 kcal/mol
ΔG(③) = ΔG(①) + ΔG(②) = -14.3 kcal/mol - 7.3 kcal/mol = -21.6 kcal/mol
하지만 질문에서는 ΔG 값을 양수로 표현하고 있으므로, -(-21.6 kcal/mol) = 21.6 kcal/mol 이다. 이 값을 58.2 kJ/mol로 환산하면 0.3이 된다. 따라서 정답은 "0.3"이다.
ΔG(①) = -14.3 kcal/mol
ΔG(②) = -7.3 kcal/mol
ΔG(③) = ΔG(①) + ΔG(②) = -14.3 kcal/mol - 7.3 kcal/mol = -21.6 kcal/mol
하지만 질문에서는 ΔG 값을 양수로 표현하고 있으므로, -(-21.6 kcal/mol) = 21.6 kcal/mol 이다. 이 값을 58.2 kJ/mol로 환산하면 0.3이 된다. 따라서 정답은 "0.3"이다.
연도별
진행 상황
0 오답
0 정답