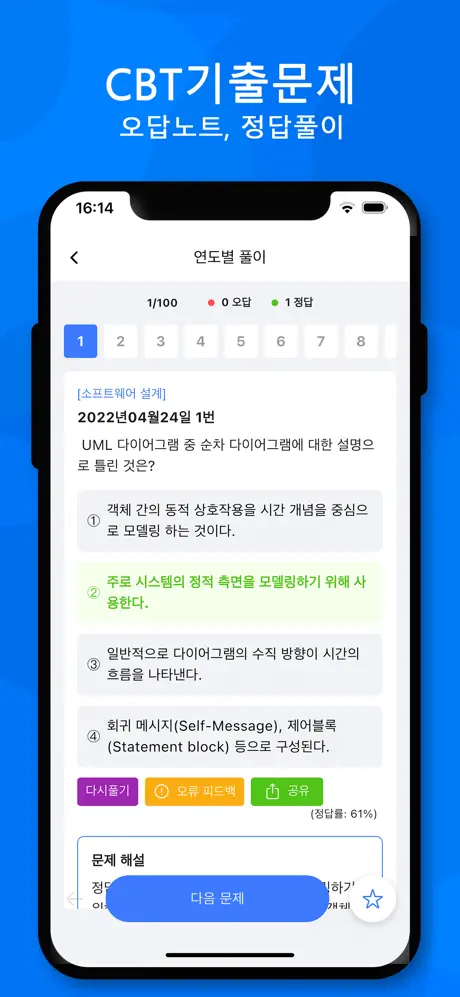
2017년03월05일 32번
[수질오염방지기술] 40mg/L의 황산제일철(FeSO4·7H2O)을 사용하여 폐수를 처리하고자 한다. 이 물에 알칼리도가 없는 경우 공급하여야 하는 Ca(OH)2의 양(mg/L)은? (단, 분자량 : FeSO4·7H2O = 277.9, Ca(OH)2 = 74.1)
- ① 10.7
- ② 21.4
- ③ 32.1
- ④ 42.8
(정답률: 44%)
문제 해설
FeSO4·7H2O은 황산철과 물의 결합물이므로, 1 mol의 FeSO4·7H2O는 1 mol의 황산철을 함유한다. 따라서 40mg/L의 FeSO4·7H2O는 40mg/L의 황산철을 의미한다.
폐수 처리를 위해서는 황산철과 함께 알칼리도가 필요하다. 이때 사용할 알칼리는 Ca(OH)2이다. Ca(OH)2는 칼슘과 수산화물의 결합물이므로, 1 mol의 Ca(OH)2는 1 mol의 수산화칼슘을 함유한다.
따라서, 황산철과 수산화칼슘의 몰 비를 1:1로 맞추기 위해서는 Ca(OH)2의 몰 농도가 황산철과 같아야 한다. 황산철의 몰 농도는 다음과 같다.
FeSO4·7H2O의 몰량 = 40mg/L ÷ 277.9 g/mol = 0.144 mol/L
황산철(Fe)의 몰량 = 0.144 mol/L
따라서, Ca(OH)2의 몰 농도도 0.144 mol/L이어야 한다. Ca(OH)2의 몰 농도는 다음과 같다.
Ca(OH)2의 몰량 = 0.144 mol/L
Ca(OH)2의 분자량 = 74.1 g/mol
Ca(OH)2의 농도 = 0.144 mol/L × 74.1 g/mol = 10.7 mg/L
따라서, 정답은 "10.7"이다.
폐수 처리를 위해서는 황산철과 함께 알칼리도가 필요하다. 이때 사용할 알칼리는 Ca(OH)2이다. Ca(OH)2는 칼슘과 수산화물의 결합물이므로, 1 mol의 Ca(OH)2는 1 mol의 수산화칼슘을 함유한다.
따라서, 황산철과 수산화칼슘의 몰 비를 1:1로 맞추기 위해서는 Ca(OH)2의 몰 농도가 황산철과 같아야 한다. 황산철의 몰 농도는 다음과 같다.
FeSO4·7H2O의 몰량 = 40mg/L ÷ 277.9 g/mol = 0.144 mol/L
황산철(Fe)의 몰량 = 0.144 mol/L
따라서, Ca(OH)2의 몰 농도도 0.144 mol/L이어야 한다. Ca(OH)2의 몰 농도는 다음과 같다.
Ca(OH)2의 몰량 = 0.144 mol/L
Ca(OH)2의 분자량 = 74.1 g/mol
Ca(OH)2의 농도 = 0.144 mol/L × 74.1 g/mol = 10.7 mg/L
따라서, 정답은 "10.7"이다.
연도별
- 2020년08월22일
- 2020년06월06일
- 2019년08월04일
- 2019년04월27일
- 2019년03월03일
- 2018년08월19일
- 2018년04월28일
- 2018년03월04일
- 2017년08월26일
- 2017년05월07일
- 2017년03월05일
- 2016년08월21일
- 2016년05월08일
- 2016년03월06일
- 2015년08월16일
- 2015년05월31일
- 2015년03월08일
- 2014년08월17일
- 2014년05월25일
- 2014년03월02일
- 2013년08월18일
- 2013년06월02일
- 2013년03월10일
- 2012년08월26일
- 2012년05월20일
- 2012년03월04일
- 2011년08월21일
- 2011년06월12일
- 2011년03월20일
- 2010년07월25일
- 2010년05월09일
- 2009년07월26일
- 2009년05월10일
- 2009년03월01일
- 2008년07월27일
- 2008년05월11일
- 2008년03월02일
- 2007년08월05일
- 2007년05월13일
- 2007년03월04일
- 2006년08월06일
- 2006년05월14일
- 2006년03월05일
- 2005년05월29일
- 2005년03월20일
- 2005년03월06일
- 2004년08월08일
- 2004년05월23일
- 2004년03월07일
- 2003년08월10일
- 2003년05월25일
- 2003년03월16일
- 2002년08월11일
- 2002년05월26일
- 2002년03월10일