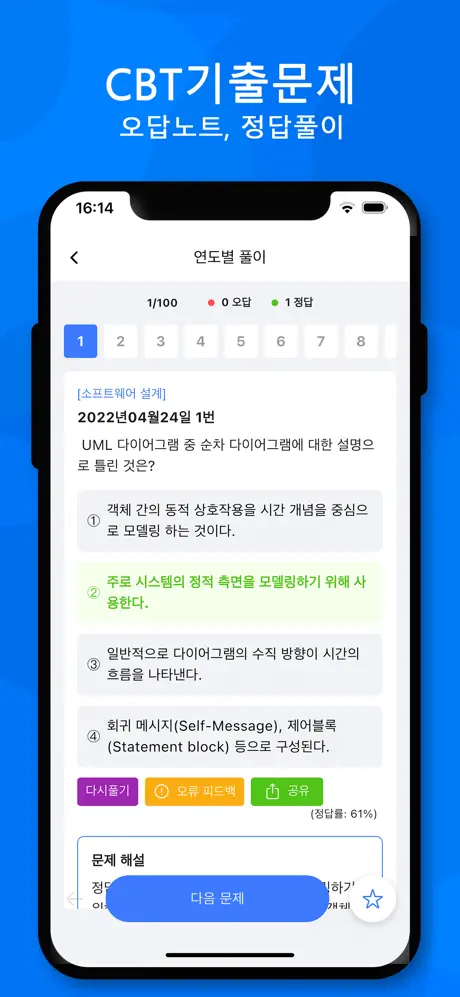
2013년06월02일 16번
[수질오염개론] 0.05N의 약산인 초산이 16% 해리되어 있다면 이 수용액의 pH는?
- ① 2.1
- ② 2.3
- ③ 2.6
- ④ 2.9
(정답률: 80%)
문제 해설
연도별
- 2020년08월22일
- 2020년06월06일
- 2019년08월04일
- 2019년04월27일
- 2019년03월03일
- 2018년08월19일
- 2018년04월28일
- 2018년03월04일
- 2017년08월26일
- 2017년05월07일
- 2017년03월05일
- 2016년08월21일
- 2016년05월08일
- 2016년03월06일
- 2015년08월16일
- 2015년05월31일
- 2015년03월08일
- 2014년08월17일
- 2014년05월25일
- 2014년03월02일
- 2013년08월18일
- 2013년06월02일
- 2013년03월10일
- 2012년08월26일
- 2012년05월20일
- 2012년03월04일
- 2011년08월21일
- 2011년06월12일
- 2011년03월20일
- 2010년07월25일
- 2010년05월09일
- 2009년07월26일
- 2009년05월10일
- 2009년03월01일
- 2008년07월27일
- 2008년05월11일
- 2008년03월02일
- 2007년08월05일
- 2007년05월13일
- 2007년03월04일
- 2006년08월06일
- 2006년05월14일
- 2006년03월05일
- 2005년05월29일
- 2005년03월20일
- 2005년03월06일
- 2004년08월08일
- 2004년05월23일
- 2004년03월07일
- 2003년08월10일
- 2003년05월25일
- 2003년03월16일
- 2002년08월11일
- 2002년05월26일
- 2002년03월10일
HCOOH ⇌ H+ + COO-
해리도가 16%이므로, 0.05N의 초산 수용액에서 해리된 H+의 몰농도는 다음과 같습니다.
0.05N × 0.16 = 0.008 mol/L
따라서, pH는 다음과 같이 계산됩니다.
pH = -log[H+]
= -log(0.008)
= 2.1
따라서, 정답은 "2.1"입니다.