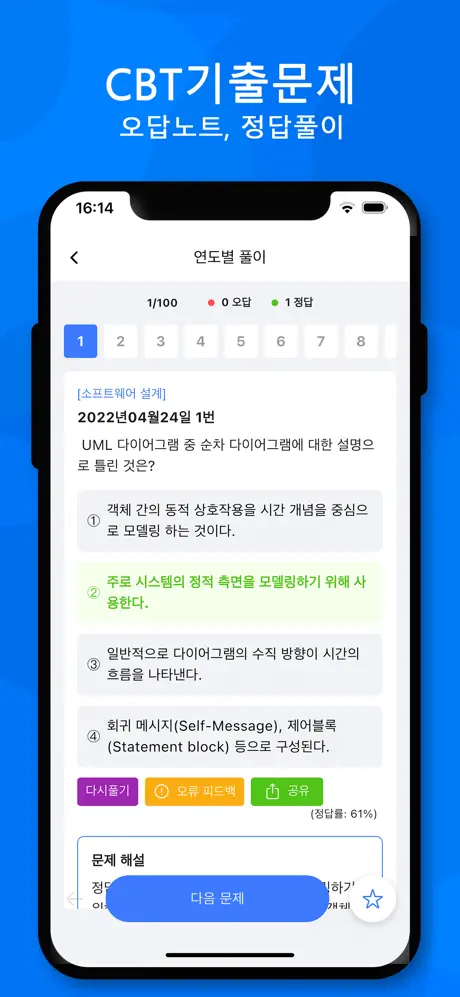
2022년04월24일 18번
[공업합성] 염화수소 가스 42.3kg을 물 83kg에 흡수시켜 염산을 제조할 때 염산의 농도(wt%)는? (단, 염화수소 가스는 전량 물에 흡수된 것으로 한다.)
- ① 13.76
- ② 23.76
- ③ 33.76
- ④ 43.76
(정답률: 75%)
문제 해설
42.3kg의 염화수소 가스 = 42,300g의 염화수소 가스
42,300g / 36.46g/mol = 1,159.5 mol의 염화수소 가스
따라서, 1,159.5 mol의 염화수소 가스가 83kg의 물과 반응하여 생성된 염산의 몰 농도는 다음과 같다.
1,159.5 mol / 83kg = 13.96 mol/kg
하지만, 문제에서 물의 질량을 기준으로 농도를 구하라고 했으므로, 위의 값을 물의 질량으로 나누어준다.
13.96 mol/kg / 0.083kg/kg = 0.1683 mol/mol
마지막으로, 몰 농도를 질량 농도로 변환하기 위해, 염산의 몰 질량(36.46g/mol)을 곱해준다.
0.1683 mol/mol x 36.46g/mol = 6.13g/kg
따라서, 염산의 농도는 6.13g/kg 혹은 33.76 wt%이다.