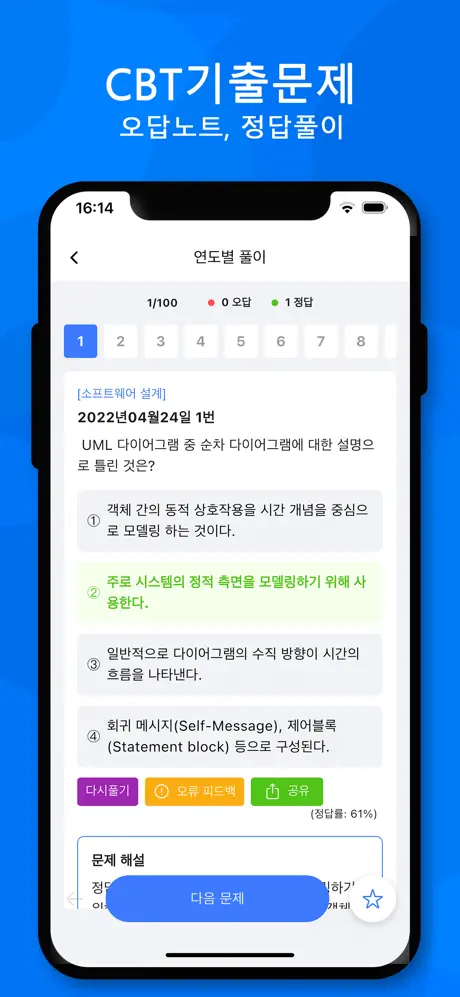
2003년05월25일 33번
[내연기관] 1 kgf 의 탄소를 완전히 연소시키는데 필요한 산소량은 얼마인가?
- ① 4.67 kgf
- ② 1.67 kgf
- ③ 2.67 kgf
- ④ 3.67 kgf
(정답률: 알수없음)
문제 해설
연도별
진행 상황
0 오답
0 정답
C + O2 → CO2
이 반응식에서 탄소 1mol에 대해 산소 1mol이 필요합니다. 산소의 분자량은 32g/mol이므로, 탄소 12g에 대해 산소 32g이 필요합니다. 따라서 탄소 1kgf에 대해 산소는 다음과 같이 계산할 수 있습니다.
1kgf 탄소 = 1000g / 12g/mol = 83.33 mol 탄소
83.33 mol 탄소 × 1mol 산소 / 1mol 탄소 = 83.33 mol 산소
산소의 질량은 다음과 같이 계산할 수 있습니다.
83.33 mol 산소 × 32g/mol = 2666.56g = 2.67kgf
따라서, 탄소 1kgf를 완전히 연소시키는데 필요한 산소량은 2.67kgf입니다.