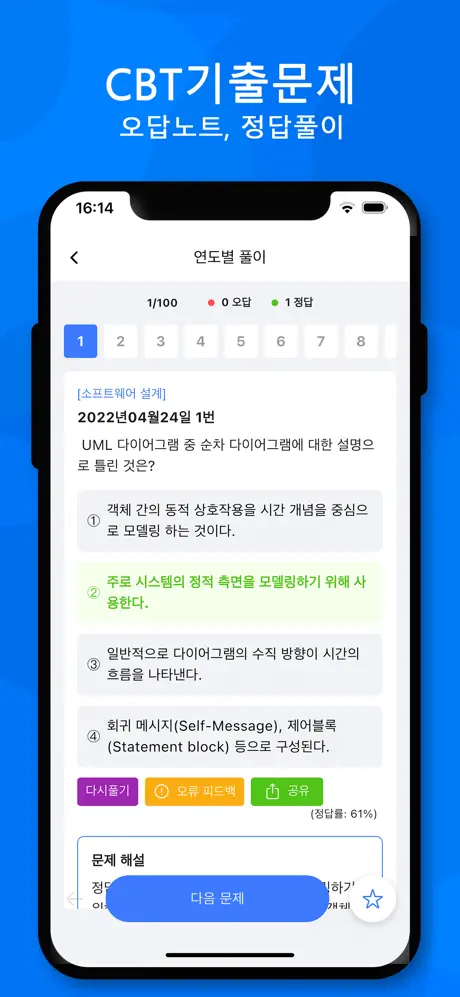
2008년09월07일 23번
[열역학] 20℃, 100kPa에서 상대습도가 80%인 공기의 몰습도는 약 얼마인가? (단, 20℃에서 물의 포화증기압은 2.3kPa이다.)
- ① 0.019
- ② 0.023
- ③ 0.035
- ④ 0.041
(정답률: 34%)
문제 해설
연도별
- 2022년04월24일
- 2022년03월05일
- 2021년09월12일
- 2021년05월15일
- 2021년03월07일
- 2020년09월26일
- 2020년08월22일
- 2020년06월06일
- 2019년09월21일
- 2019년04월27일
- 2019년03월03일
- 2018년09월15일
- 2018년04월28일
- 2018년03월04일
- 2017년09월23일
- 2017년05월07일
- 2017년03월05일
- 2016년10월01일
- 2016년05월08일
- 2016년03월06일
- 2015년09월19일
- 2015년05월31일
- 2015년03월08일
- 2014년09월20일
- 2014년05월25일
- 2014년03월02일
- 2013년09월28일
- 2013년06월02일
- 2013년03월10일
- 2012년09월15일
- 2012년05월20일
- 2012년03월04일
- 2011년10월02일
- 2011년06월12일
- 2011년03월20일
- 2010년09월05일
- 2010년05월09일
- 2010년03월07일
- 2009년08월30일
- 2009년03월01일
- 2008년09월07일
- 2007년05월13일
- 2007년03월04일
- 2006년05월14일
- 2006년03월05일
- 2005년05월29일
- 2005년03월20일
- 2005년03월06일
- 2004년09월05일
- 2004년05월23일
- 2004년03월07일
- 2003년08월31일
- 2003년05월25일
- 2003년03월16일
진행 상황
0 오답
0 정답
이제, 이 공기의 몰습도를 구하기 위해서는 현재 온도와 압력에서의 수증기의 몰수를 계산해야 합니다. 이를 위해서는 먼저 수증기의 분압을 계산해야 하는데, 이는 물의 포화증기압과 상대습도를 이용하여 구할 수 있습니다.
수증기 분압 = 상대습도 * 물의 포화증기압 = 0.8 * 2.3kPa = 1.84kPa
이제, 이 수증기 분압을 이용하여 공기와 수증기의 혼합기체의 몰수를 계산할 수 있습니다. 이때, 공기와 수증기의 분압의 합은 전체 기체의 압력과 같으므로, 다음과 같은 식을 이용할 수 있습니다.
P = P_air + P_water vapor = 100kPa
P_air = P - P_water vapor = 100kPa - 1.84kPa = 98.16kPa
이제, 공기와 수증기의 몰수를 계산하기 위해 다음과 같은 식을 이용할 수 있습니다.
n = P V / (R T)
여기서, P는 해당 기체의 분압, V는 해당 기체의 체적, R은 기체 상수, T는 절대온도입니다. 이를 이용하여 공기와 수증기의 몰수를 계산하면 다음과 같습니다.
공기의 몰수 = (98.16kPa * V) / (8.314 * 293K) = 3.77V / L
수증기의 몰수 = (1.84kPa * V) / (8.314 * 293K) = 0.071V / L
따라서, 공기와 수증기의 혼합기체의 몰수는 다음과 같습니다.
n_total = n_air + n_water vapor = 3.77V / L + 0.071V / L = 3.841V / L
마지막으로, 이를 체적 당 몰수로 변환하기 위해 체적 1L당의 몰수로 나누어 주면 다음과 같습니다.
체적 당 몰수 = 3.841V / L / 1L = 3.841 mol / m^3
따라서, 이 문제에서 구한 공기의 몰습도는 3.841 mol / m^3입니다. 이를 소수점 셋째 자리까지 반올림하여 정답은 "0.019"입니다.