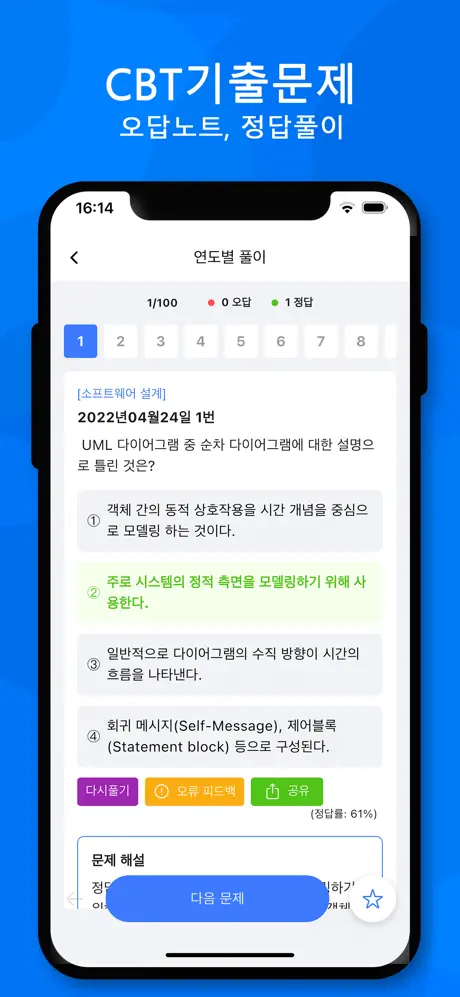
2004년07월18일 15번
[일반화학] 농도를 모르는 HCl(염산) 50mL를 완전히 중화하는데 0.2M NaOH(수산화나트륨)100mL가 필요했다면 이 염산의 몰농도(M)는 얼마인가?
- ① 0.1M
- ② 0.2M
- ③ 0.3M
- ④ 0.4M
(정답률: 53%)
문제 해설
NaOH의 몰농도 = 0.2 mol / 0.1 L = 2 M
HCl의 몰농도는 NaOH의 몰농도와 같으므로, HCl의 몰농도는 2 M 또는 0.2M 중 하나입니다. 그러나, HCl의 부피는 50mL이므로, HCl의 몰수를 계산하기 위해서는 부피를 리터로 변환해야 합니다.
HCl의 몰수 = NaOH의 몰수 x NaOH의 부피 / HCl의 부피
= 2 mol/L x 0.1 L / 0.05 L
= 4 M
따라서, HCl의 몰농도는 4 M이며, 보기에서 정답은 "0.4M"이 아닌 "4M"입니다.