2004년07월18일 1번
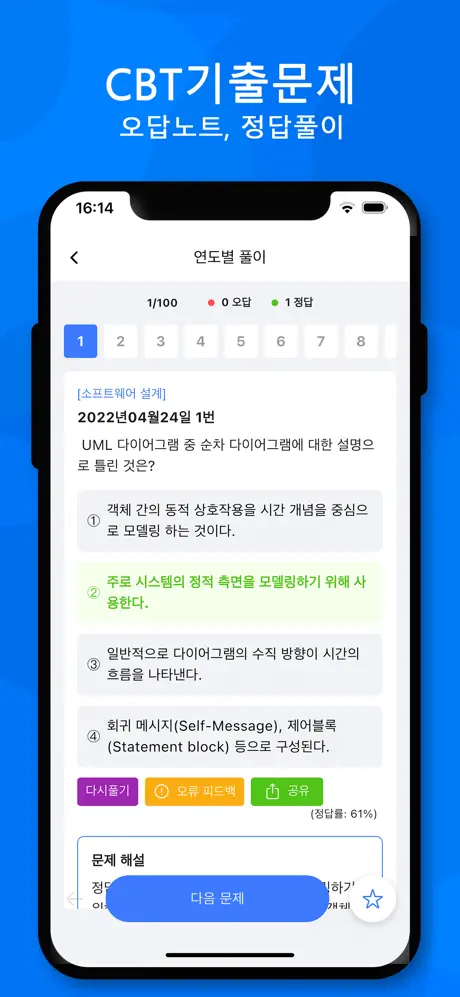
[일반화학] 0℃, 1기압에서 1m3의 아세틸렌을 얻으려면 순도 85%의 탄화칼슘 몇 ㎏이 필요한가? (단, 탄화칼슘 분자량은 64이다.)
- ① 1.4㎏
- ② 3.36㎏
- ③ 5.29㎏
- ④ 11.2㎏
(정답률: 63%)
문제 해설
이전 문제
다음 문제
탄화칼슘과 물이 반응하여 아세틸렌을 생성하는 반응식은 다음과 같다.
CaC2 + 2H2O → Ca(OH)2 + C2H2
몰 비를 이용하여 계산하면, 2mol의 C2H2를 얻기 위해서는 1mol의 CaC2가 필요하다.
따라서, 2m3의 C2H2를 얻기 위해서는 1mol의 CaC2가 필요하며, 이는 64g의 CaC2에 해당한다.
순도가 85%이므로, 1m3의 아세틸렌을 얻기 위해서는 다음과 같이 계산할 수 있다.
1m3의 아세틸렌을 얻기 위해서는 2m3의 C2H2가 필요하므로, 2 × 26.04g = 52.08g의 순수한 C2H2가 필요하다.
따라서, 1m3의 아세틸렌을 얻기 위해서는 52.08g / 0.85 = 61.27g의 탄화칼슘이 필요하다.
이를 kg으로 환산하면, 61.27g / 1000g/kg = 0.06127kg이다.
따라서, 0℃, 1기압에서 1m3의 아세틸렌을 얻으려면 순도 85%의 탄화칼슘 3.36㎏이 필요하다.