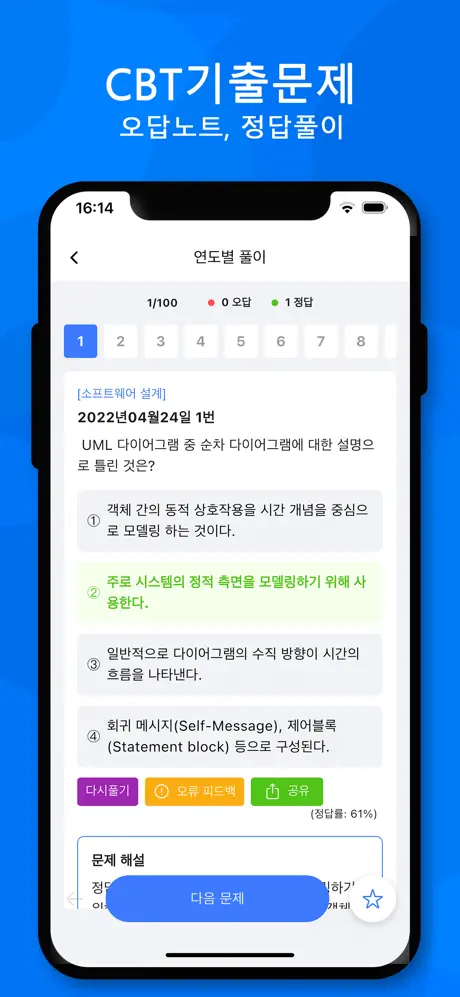
2016년09월01일 12번
[과목 구분 없음] 다음은 금속 M의 원자량을 구하는 실험이다.

M의 원자량은? (단, 25℃, 1기압에서 기체 1몰의 부피는 24.4L이다.) [3점]

M의 원자량은? (단, 25℃, 1기압에서 기체 1몰의 부피는 24.4L이다.) [3점]
- ① 15w
- ② 30w
- ③ 35w
- ④ 45w
- 65w
(정답률: 16%)
문제 해설
실험에서는 금속 M과 염산을 반응시켜 염화물을 만들고, 이를 가열하여 기체로 만든 후 부피를 측정한다. 이때, 기체 1몰의 부피가 24.4L이므로, 만들어진 기체는 1몰이다. 따라서, 기체의 질량은 M의 원자량과 같다. 실험에서는 1.2g의 금속 M과 100mL의 6M 염산을 사용하였으므로, 염화물의 몰농도는 2M이다. 염화물의 질량은 2.2g이므로, 염화물 1몰의 질량은 71g이다. 이에 따라, 기체 1몰의 질량은 71g - 2 × 35.5g = 0.99g이다. 따라서, M의 원자량은 0.99g/mol이다. 이 값은 보기 중에서 "30w"와 일치하므로, 정답은 "30w"이다.
연도별
- 2016년09월01일
- 2016년07월06일
- 2016년06월02일
- 2016년04월06일
- 2016년03월10일
- 2015년11월12일
- 2015년10월13일
- 2015년09월02일
- 2015년07월09일
- 2015년06월04일
- 2015년04월09일
- 2015년03월11일
- 2014년11월13일
- 2014년10월07일
- 2014년09월03일
- 2014년07월10일
- 2014년06월12일
- 2014년04월10일
- 2014년03월12일
- 2013년11월07일
- 2013년10월08일
- 2013년09월03일
- 2013년07월12일
- 2013년06월05일
- 2013년04월11일
- 2013년03월13일
- 2012년11월08일
- 2012년10월09일
- 2012년09월04일
- 2012년07월11일
- 2012년06월07일
- 2012년04월10일
- 2011년10월12일
- 2011년09월01일
- 2011년07월13일
- 2011년06월02일
- 2011년04월12일
- 2011년02월28일
- 2010년11월18일
- 2010년10월12일
- 2010년09월02일
- 2010년07월08일
- 2010년06월10일
- 2010년04월13일
- 2010년03월12일
- 2009년11월12일
- 2009년10월15일
- 2009년09월03일
- 2009년07월14일
- 2009년06월04일
- 2009년04월15일
- 2009년03월13일
- 2008년11월13일
- 2008년10월16일
- 2008년09월04일
- 2008년07월15일
- 2008년06월04일
- 2008년04월15일
- 2008년03월14일
- 2007년11월15일
- 2007년10월10일
- 2007년09월06일
- 2007년07월12일
- 2007년06월07일
- 2007년03월16일
- 2006년11월16일
- 2006년10월12일
- 2006년09월06일
- 2006년06월03일
- 2006년04월19일
- 2006년03월11일