2007년03월16일 2번
[과목 구분 없음] 표는 수산화나트륨(NaOH) 수용액과 묽은 염산 (HCl)을 각각 부피를 달리하여 스티로폼 용기에 넣은 다음 혼합 용액의 최고 온도를 측정한 결과이다. (단, 혼합 전 용액의 온도는 모두 18℃이고, 각 혼합 용액의 비열은 같다.)
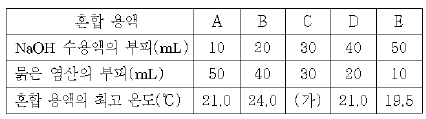
혼합 용액 A~E에 대한 설명으로 옳은 것은? [3점]

혼합 용액 A~E에 대한 설명으로 옳은 것은? [3점]
- ① (가)는 27.0℃이다.
- ② C에서 Na+과 Cl-의 수는 같다.
- ③ 전기 전도도가 가장 작은 것은 B이다.
- ④ D에 마그네슘을 넣으면 수소 기체가 발생한다.
- A와 B에서 중화 반응으로 생성된 물의 양은 같다.
(정답률: 알수없음)
문제 해설
- A: 전기 전도도가 가장 높은 것은 A이다. (온도가 높아질수록 전기 전도도가 증가하기 때문)
- B: 전기 전도도가 가장 작은 것은 C이다. (NaOH와 HCl이 중화 반응을 일으켜 NaCl과 H2O가 생성되기 때문에 이온이 많이 없어져 전기 전도도가 낮아진다)
- C: C에서 Na+과 Cl-의 수는 같다. (NaOH와 HCl이 1:1 몰비로 반응하기 때문에 생성된 NaCl의 이온 수는 같다)
- D: D에 마그네슘을 넣으면 수소 기체가 발생한다. (HCl과 반응하여 수소 기체가 발생한다)
- E: A와 B에서 중화 반응으로 생성된 물의 양은 같다. (NaOH와 HCl이 1:1 몰비로 반응하기 때문에 생성된 물의 양은 같다)
- B: 전기 전도도가 가장 작은 것은 C이다. (NaOH와 HCl이 중화 반응을 일으켜 NaCl과 H2O가 생성되기 때문에 이온이 많이 없어져 전기 전도도가 낮아진다)
- C: C에서 Na+과 Cl-의 수는 같다. (NaOH와 HCl이 1:1 몰비로 반응하기 때문에 생성된 NaCl의 이온 수는 같다)
- D: D에 마그네슘을 넣으면 수소 기체가 발생한다. (HCl과 반응하여 수소 기체가 발생한다)
- E: A와 B에서 중화 반응으로 생성된 물의 양은 같다. (NaOH와 HCl이 1:1 몰비로 반응하기 때문에 생성된 물의 양은 같다)
연도별
- 2016년09월01일
- 2016년07월06일
- 2016년06월02일
- 2016년04월06일
- 2016년03월10일
- 2015년11월12일
- 2015년10월13일
- 2015년09월02일
- 2015년07월09일
- 2015년06월04일
- 2015년04월09일
- 2015년03월11일
- 2014년11월13일
- 2014년10월07일
- 2014년09월03일
- 2014년07월10일
- 2014년06월12일
- 2014년04월10일
- 2014년03월12일
- 2013년11월07일
- 2013년10월08일
- 2013년09월03일
- 2013년07월12일
- 2013년06월05일
- 2013년04월11일
- 2013년03월13일
- 2012년11월08일
- 2012년10월09일
- 2012년09월04일
- 2012년07월11일
- 2012년06월07일
- 2012년04월10일
- 2011년10월12일
- 2011년09월01일
- 2011년07월13일
- 2011년06월02일
- 2011년04월12일
- 2011년02월28일
- 2010년11월18일
- 2010년10월12일
- 2010년09월02일
- 2010년07월08일
- 2010년06월10일
- 2010년04월13일
- 2010년03월12일
- 2009년11월12일
- 2009년10월15일
- 2009년09월03일
- 2009년07월14일
- 2009년06월04일
- 2009년04월15일
- 2009년03월13일
- 2008년11월13일
- 2008년10월16일
- 2008년09월04일
- 2008년07월15일
- 2008년06월04일
- 2008년04월15일
- 2008년03월14일
- 2007년11월15일
- 2007년10월10일
- 2007년09월06일
- 2007년07월12일
- 2007년06월07일
- 2007년03월16일
- 2006년11월16일
- 2006년10월12일
- 2006년09월06일
- 2006년06월03일
- 2006년04월19일
- 2006년03월11일