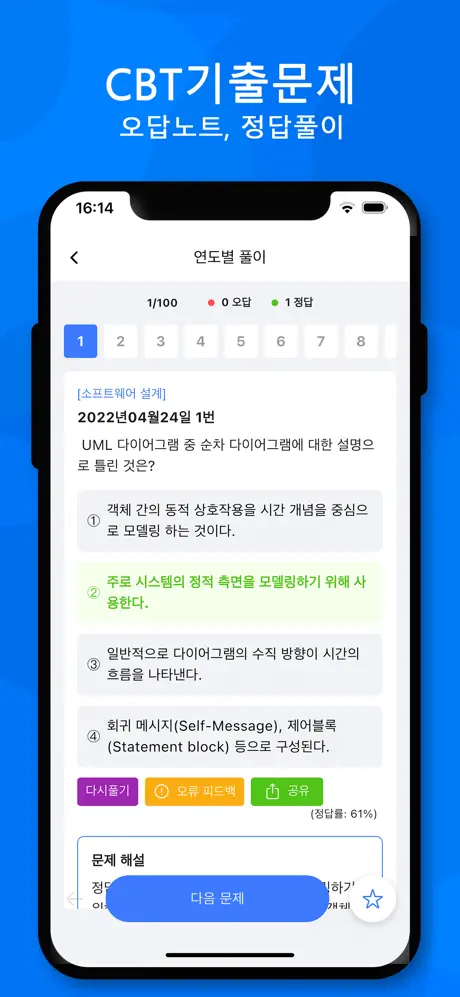
2015년04월04일 10번
[임의 구분] 200kg 의 순수한 석회석(CaCO3) 중 CaO 의 함량은 얼마인가? (단, 원자량은 Ca : 40, C : 12, O : 16 이다.)
- ① 56kg
- ② 84kg
- ③ 112kg
- ④ 156kg
(정답률: 84%)
문제 해설