2016년03월10일 3번
[과목 구분 없음] 다음은 CaCO3(s)과 HCl(aq)의 반응의 화학 반응식이다.
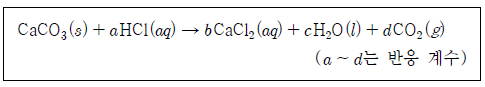
NaCl(s)과 CaCO3(s)의 혼합물 X 50g을 충분한 양의 HCl(aq)에 넣어 반응시켰더니 CO2(g)가 4 L 생성되었다. X에서 CaCO3의 질량 백분율(%)은? (단, 실험 조건에서 기체 1몰의 부피는 24 L이고, CaCO3의 화학식량은 100이다.)
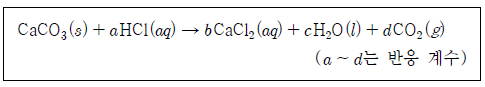
NaCl(s)과 CaCO3(s)의 혼합물 X 50g을 충분한 양의 HCl(aq)에 넣어 반응시켰더니 CO2(g)가 4 L 생성되었다. X에서 CaCO3의 질량 백분율(%)은? (단, 실험 조건에서 기체 1몰의 부피는 24 L이고, CaCO3의 화학식량은 100이다.)
- ① 50/3
- ② 100/3
- ③ 50
- ④ 200/3
- 250/3
(정답률: 알수없음)
문제 해설
반응식을 보면 1 몰의 CaCO3가 2 몰의 HCl과 반응하여 1 몰의 CO2를 생성한다. 따라서 4 L의 CO2가 생성되었으므로, 이는 1 몰의 CO2가 생성한 부피인 24 L의 4/24 = 1/6 몰에 해당한다. 따라서 1 몰의 CaCO3가 2 몰의 HCl과 반응하여 1/6 몰의 CO2를 생성하므로, 1 몰의 CaCO3는 2/1/6 = 12 몰의 HCl과 반응한다. 따라서 50g의 혼합물 X에서 CaCO3의 질량은 100g이므로, 100g의 CaCO3는 12 몰의 HCl과 반응한다. 이때, CaCO3의 질량 백분율(%)은 (100g / 150g) × 100% = 100/3% 이다. 따라서 정답은 "100/3"이다.
연도별
- 2016년09월01일
- 2016년07월06일
- 2016년06월02일
- 2016년04월06일
- 2016년03월10일
- 2015년11월12일
- 2015년10월13일
- 2015년09월02일
- 2015년07월09일
- 2015년06월04일
- 2015년04월09일
- 2015년03월11일
- 2014년11월13일
- 2014년10월07일
- 2014년09월03일
- 2014년07월10일
- 2014년06월12일
- 2014년04월10일
- 2014년03월12일
- 2013년11월07일
- 2013년10월08일
- 2013년09월03일
- 2013년07월12일
- 2013년06월05일
- 2013년04월11일
- 2013년03월13일
- 2012년11월08일
- 2012년10월09일
- 2012년09월04일
- 2012년07월11일
- 2012년06월07일
- 2012년04월10일
- 2011년10월12일
- 2011년09월01일
- 2011년07월13일
- 2011년06월02일
- 2011년04월12일
- 2011년02월28일
- 2010년11월18일
- 2010년10월12일
- 2010년09월02일
- 2010년07월08일
- 2010년06월10일
- 2010년04월13일
- 2010년03월12일
- 2009년11월12일
- 2009년10월15일
- 2009년09월03일
- 2009년07월14일
- 2009년06월04일
- 2009년04월15일
- 2009년03월13일
- 2008년11월13일
- 2008년10월16일
- 2008년09월04일
- 2008년07월15일
- 2008년06월04일
- 2008년04월15일
- 2008년03월14일
- 2007년11월15일
- 2007년10월10일
- 2007년09월06일
- 2007년07월12일
- 2007년06월07일
- 2007년03월16일
- 2006년11월16일
- 2006년10월12일
- 2006년09월06일
- 2006년06월03일
- 2006년04월19일
- 2006년03월11일