2010년09월02일 20번
[과목 구분 없음] 그림은 금속 A와 B가 염산(HCl)과 반응할 때, 반응하는 금속 원자수에 따라 생성되는 수소(H2)의 분자수를 나타낸 것이다.
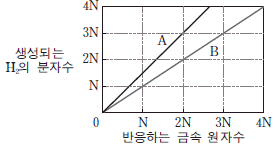
A와 B로 만들어진 어떤 합금이 충분한 양의 HCl과 모두 반응할 때, A와 B가 산화되어 각각 발생한 수소 기체의 부피비는 3 : 1이다. 이 반응에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 원자 A와 B의 상대 질량비는 3 : 7이다.) [3점]

A와 B로 만들어진 어떤 합금이 충분한 양의 HCl과 모두 반응할 때, A와 B가 산화되어 각각 발생한 수소 기체의 부피비는 3 : 1이다. 이 반응에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 원자 A와 B의 상대 질량비는 3 : 7이다.) [3점]

- ① ㄱ
- ② ㄷ
- ③ ㄱ, ㄴ
- ④ ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
(정답률: 알수없음)
문제 해설
보기 중 정답은 "ㄱ"이다. 이유는 A와 B가 산화되어 발생한 수소 기체의 부피비가 3:1이므로, A와 B가 반응할 때 생성되는 수소 분자수 비율도 3:1이다. 따라서, A와 B의 원자수 비율도 3:1이어야 한다. 상대 질량비가 3:7이므로, A와 B의 원자량 비율은 3:(7/3)이다. 이 비율을 간단하게 하면 9:7이 된다. 따라서, A와 B의 원자수 비율은 9:7이어야 하며, 이 비율에 따라 생성되는 수소 분자수 비율이 3:1이 되므로, A는 9개의 원자, B는 7개의 원자로 이루어져 있어야 한다. 이에 따라, A는 Cu, B는 Al로 추론할 수 있다.
이전 문제
다음 문제
연도별
- 2016년09월01일
- 2016년07월06일
- 2016년06월02일
- 2016년04월06일
- 2016년03월10일
- 2015년11월12일
- 2015년10월13일
- 2015년09월02일
- 2015년07월09일
- 2015년06월04일
- 2015년04월09일
- 2015년03월11일
- 2014년11월13일
- 2014년10월07일
- 2014년09월03일
- 2014년07월10일
- 2014년06월12일
- 2014년04월10일
- 2014년03월12일
- 2013년11월07일
- 2013년10월08일
- 2013년09월03일
- 2013년07월12일
- 2013년06월05일
- 2013년04월11일
- 2013년03월13일
- 2012년11월08일
- 2012년10월09일
- 2012년09월04일
- 2012년07월11일
- 2012년06월07일
- 2012년04월10일
- 2011년10월12일
- 2011년09월01일
- 2011년07월13일
- 2011년06월02일
- 2011년04월12일
- 2011년02월28일
- 2010년11월18일
- 2010년10월12일
- 2010년09월02일
- 2010년07월08일
- 2010년06월10일
- 2010년04월13일
- 2010년03월12일
- 2009년11월12일
- 2009년10월15일
- 2009년09월03일
- 2009년07월14일
- 2009년06월04일
- 2009년04월15일
- 2009년03월13일
- 2008년11월13일
- 2008년10월16일
- 2008년09월04일
- 2008년07월15일
- 2008년06월04일
- 2008년04월15일
- 2008년03월14일
- 2007년11월15일
- 2007년10월10일
- 2007년09월06일
- 2007년07월12일
- 2007년06월07일
- 2007년03월16일
- 2006년11월16일
- 2006년10월12일
- 2006년09월06일
- 2006년06월03일
- 2006년04월19일
- 2006년03월11일